
- D. Bröll, C. Kaul, A. Krämer, P. Krammer, T. Richter, M. Jung, H. Vogel, P. Zehner, Angew. Chem. Int. Ed., 1999, 38, 2998-3014.
- P.E. Savage, Chem. Rev., 1999, 99, 603-621.
- F. Cansell, B. Chevalier, A. Demourgues, J. Etourneau, C. Even, Y. Garrabos, V. Pessey, S. Petit, A. Tressand, F. Weill, J. Mater. Chem., 1999, 9, 67-75.
- P. Kritzer, E. Dinjus, Chem. Eng. J., 2001, 83, 207-214.
- N. Akiya, P.E. Savage, Chem. Rev., 2002, 102, 2725-2750.
- S. Yesodharan, Curr. Sci., 2002, 82, 1112-1122.
- J.W. Griffith, D.H. Raymond, Waste Manage., 2002, 22, 453-459.
- S.E. Hunter, C.A. Felczak, P.E. Savage, Green Chem., 2004, 6, 222-226.
- M. Hodes, P.A. Marrone, G.T. Hong, K.A. Smith, J.W. Tester, J. Supercrit. Fluids, 2004, 29, 265-288.
- P.A. Marrone, M. Hodes, K.A. Smith, J.W. Tester, J. Supercrit. Fluids, 2004, 29, 289-312.
- H. Pińkowska, Przem. Chem., 2006, 85, 242-248 (wraz z literaturą cytowaną).
- R. Bogoczek, H. Pińkowska, Przem. Chem., 2006, 85, 894-897 (wraz z literaturą cytowaną).
- H. Pińkowska, Polimery, 2006, 51, 836-842.
- H. Pińkowska, Przem. Chem., 2007, 86, 599
- B. Burczyk, Zielona Chemia. Zarys. Oficyna Wydawnicza Politechniki Wrocławskiej. Wrocław, 2006.
- O. Tavakoli, H. Yoshida, Green Chem., 2006, 8, 100-106.
- A. Kruse, E. Dinjus, J. Supercrit. Fluids, 2007, 39, 362-380.
- T. Sako, K. Matsunaga, H. Soma, I. Okajima, T. Wakuta, T. Seki, Asian Pacific Confederation of Chemical Engineering Congress Program and Abstracts, 2004. JSTAGE
-
BSCWO_final.pdf w: CA.SANDIA
- Turbosynthesis
- P. Olszowiec, Gigawat (na podstawie artykułu S. Minetti, K. Fenwick, WaterWorld Online, 07.2002).
Hanna Pińkowska, dr inż., jest absolwentką Wydziału Inżynieryjno-Ekonomicznego Uniwersytetu Ekonomicznego we Wrocławiu. Jest adiunktem w Katedrze Technologii Chemicznej tej uczelni.
Specjalność naukowa: technologia chemiczna organiczna, chemia i technologia polimerów, zielona chemia, analiza instrumentalna w monitorowaniu skażeń środowiska
Woda w stanie pod- i nadkrytycznym jako nowe medium reakcyjne
Do problemów wynikających z intensywnego rozwoju cywilizacyjnego należą nadmierne zanieczyszczenie środowiska naturalnego oraz wyczerpywanie się tradycyjnych źródeł surowców, materiałów i energii. Zanieczyszczenie środowiska jest wywołane m.in. emisją lotnych rozpuszczalników organicznych VOCs (volatile organic compounds), stosowaniem w syntezie chemicznej niebezpiecznych reagentów oraz szkodliwych katalizatorów, powstawaniem dużych ilości trudnych do efektywnego zagospodarowania poużytkowego odpadów i utylizacji toksycznych ścieków. W ostatnich latach prowadzone są badania nad możliwością zastosowania nowych, bezpiecznych dla środowiska mediów reakcyjnych, których użycie mogłoby wyeliminować konieczność stosowania szkodliwych dla środowiska rozpuszczalników i reagentów, zapewnić zmniejszenie ilości zużywanych materiałów, energii, powstających produktów ubocznych i odpadów, a także ograniczyć ryzyko i niebezpieczeństwo. Jednym z nich może stać się woda w stanie pod- i nadkrytycznym, która podobnie jak woda w warunkach normalnych jest tanim, łatwo dostępnym, nietoksycznym, niepalnym i nieszkodliwym dla środowiska rozpuszczalnikiem, a dzięki wyjątkowym właściwościom fizykochemicznym w stanie okołokrytycznym, zdolnym także do pełnienia roli katalizatora i reagenta w wielu reakcjach syntezy chemicznej, procesach hydrolitycznego przerobu związków odpadowych do produktów użytecznych, utleniającego rozkładu toksycznych lub uciążliwych dla środowiska związków organicznych. Woda w stanie pod- i nadkrytycznym może być stosowana również w procesach przemiany biomasy, prowadzących do uzyskiwania biopaliw, stanowiących alternatywę w stosunku do tradycyjnych surowców energetycznych, których spalanie wiąże się z emisją ditlenku węgla i potęguje efekt cieplarniany, przyczyniając się do niekorzystnych zmian klimatu.
Właściwości wody w stanie pod- i nadkrytycznym
Ciecz lub gaz osiągają stan nadkrytyczny i stają się płynami w stanie nadkrytycznym SCFs (supercritical fluids), gdy temperatura i ciśnienie w jakim się znajdują przekracza wartość ich parametrów krytycznych: temperatury (Tkr) i ciśnienia (Pkr). Temperatura, po przekroczeniu której substancja może znajdować się tylko w stanie gazowym nazywana jest temperaturą krytyczną, a ciśnieniem krytycznym jest ciśnienie pary nasyconej w temperaturze krytycznej. Płyny w stanie nadkrytycznym nie mogą być skroplone przez podniesienie ciśnienia ani przejść w stan gazowy poprzez podwyższenie temperatury. Po przekroczeniu punktu krytycznego zanika granica między stanem ciekłym i gazowym a powstała faza posiada właściwości pośrednie pomiędzy właściwościami cieczy i gazu (tabela 1, rys. 1). Poprzez zmianę temperatury lub ciśnienia można zmieniać wiele właściwości fizykochemicznych SCFs. Parametry krytyczne niektórych płynów w stanie nadkrytycznym przedstawiono w tabeli 2.
Tabela 1. Porównanie niektórych właściwości cieczy, gazu i płynu w stanie nadkrytycznym.
| ciecz | płyn w stanie nadkrytycznym | gaz1 | |
|
gęstość [kgm-3] |
1 000 |
100 - 800 |
1 |
|
lepkość [Pa s] |
10-3 |
10-4 - 10-5 |
10-5 |
|
współczynnik dyfuzji [m2 s-1] |
10-9 | 10-8 | 10-5 |
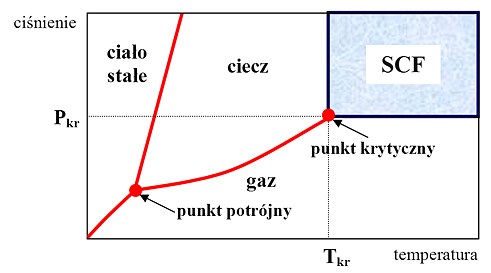
Rys. 1: Diagram fazowy pojedynczej substancji (w przypadku diagramu fazowego wody punkt potrójny wynosi T=0,01 oC, P = 611 Pa)
Tabela 2: Parametry krytyczne wybranych płynów w stanie nadkrytycznym
|
rozpuszczalnik |
Tkr [oC] |
Pkr [MPa] |
dkr [g cm-3] |
|
metan |
-82,5 |
4,64 |
0,16 |
|
etylen |
10,0 |
5,12 |
0,22 |
|
ditlenek węgla |
31,1 |
7,38 |
0,47 |
|
etan |
32,2 |
4,88 |
0,20 |
|
propylen |
91,9 |
4,61 |
0,24 |
|
propan |
96,7 |
4,25 |
0,22 |
| amoniak |
132,5 |
11,28 |
0,24 |
| n-pentan |
196,5 |
3,37 |
0,24 |
| aceton |
235,0 |
4,76 |
0,27 |
| izopropanol |
235,2 |
4,76 |
0,27 |
| metanol |
239,5 |
8,10 |
0,27 |
| etanol |
243,5 |
6,38 |
0,28 |
| benzen |
289,0 |
4,89 |
0,30 |
|
woda |
374,2 |
22,05 |
0,32 |
Wśród wielu SCFs, szczególnie interesujące właściwości wykazuje woda. Wybrane właściwości wody w warunkach normalnych (T = 25 oC, P = 0,1 MPa) oraz w stanie pod- i nadkrytycznym
przedstawiono w tabeli 3.
Tabela 3: Właściwości fizykochemiczne wody w funkcji jej temperatury i ciśnienia
|
woda w normalnych warunkach |
woda w stanie podkrytycznym |
woda w stanie nadkrytycznym |
||
| temperatura [oC] |
25 |
250 |
400 |
400 |
| ciśnienie [MPa] |
0,1 |
5 |
25 |
50 |
|
gęstość [g cm-3] |
0,997 |
0,80 |
0,17 |
0,58 |
|
stała dielektryczna |
78,5 |
27,1 |
5,9 |
10,5 |
|
iloczyn jonowy [pKw] |
14,0 |
11,2 |
19,4 |
11,9 |
|
lepkość dynamiczna [mPa] |
0,89 |
0,11 |
0,03 |
0,07 |
Pojęcie wody w stanie podkrytycznym (subcritical water) dotyczy zakresu temp. 250 oC < T < 374 oC i ciśnienia wyższego od ciśnienia krytycznego, a określenie woda w
stanie nadkrytycznym SCW (supercritical water) odnosi się do wody o wartościach temperatury i ciśnienia wyższych niż jej parametry krytyczne. Uzupełnieniem pojęć wody w stanie pod- i nadkrytycznym
jest gorąca sprężona woda HCW (high compressed water). Właściwości wody w stanie podkrytycznym a szczególnie w stanie nadkrytycznym różnią się istotnie od właściwości, jakie posiada w warunkach
normalnych (rys. 2).
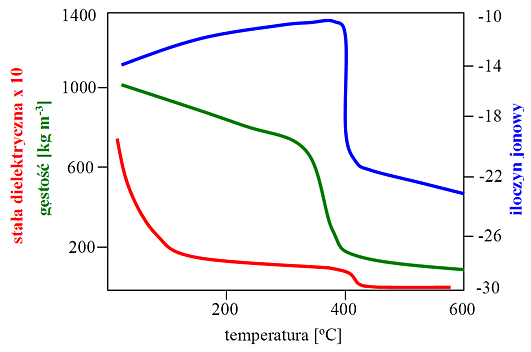
Rys. 2: Właściwości fizyczne wody (P = 24 MPa)
W pobliżu punktu krytycznego, ze wzrostem temperatury następuje rozerwanie większości wiązań wodorowych. W wodzie o temp. 400 oC jest obecnych 30-45 % początkowej liczby wiązań wodorowych, a w temp. 500 oC istnieje tylko 10-14 % wiązań. Istotne zmiany zachodzą także w kształtowaniu się stałej dielektrycznej wody, która początkowo maleje ze wzrostem temperatury, osiągając wartość wynoszącą 5,9 w temp. 400 oC i pod ciśnieniem 25 MPa, a następnie rośnie ze wzrostem ciśnienia (tabela 3). Zmiany w kształtowaniu się wartości stałej dielektrycznej powodują, że w pobliżu i powyżej punktu krytycznego woda staje się niepolarna i rozpuszczają się w niej związki niepolarne i gazy (np. tlen), natomiast rozpuszczalność związków nieorganicznych wyraźnie maleje (rozpuszczalność NaCl w wodzie w temp. 300 oC wynosi 40 % wag., a w temp. 450 oC tylko 100 ppm), a niektóre z nich stają się nierozpuszczalne. Kolejną właściwością wody, zmieniającą się wraz ze zmianą jej temperatury i ciśnienia jest iloczyn jonowy. W pobliżu punktu krytycznego stężenie jonów hydroniowych (H3O+) i hydroksylowych (OH-) jest większe niż w wodzie w warunkach normalnych (w temp. 300 oC ok. 25 razy), dlatego woda w stanie pod- i nadkrytycznym posiada właściwości katalizatora kwasowo/zasadowego. Po przekroczeniu temperatury krytycznej iloczyn jonowy wody maleje gwałtownie ze wzrostem temperatury, ale rośnie ze wzrostem ciśnienia. Wodę w stanie nadkrytycznym, w stosunku do wody w warunkach normalnych, charakteryzuje wyższy współczynnik dyfuzji oraz niższa lepkość i napięcie powierzchniowe, co powoduje że procesy transportowe zachodzące w jej obecności mogą przebiegać prawie bez ograniczeń. Podobnie jak w przypadku innych SCFs, zmieniając temperaturę i ciśnienie wody poniżej i powyżej punktu krytycznego, można odpowiednio kształtować jej właściwości. Woda w stanie pod- i nadkrytycznym może pełnić rolę rozpuszczalnika, katalizatora i reagenta w reakcjach syntezy chemicznej oraz procesach termochemicznego hydrolitycznego lub utleniającego rozkładu związków organicznych, w tym m.in. recyklingu tworzyw wielkocząsteczkowych, destrukcji i oczyszczaniu niebezpiecznych, toksycznych lub uciążliwych odpadów i ścieków, a także przemianie biomasy, prowadzącej do palnego gazu bogatego w wodór.
Zastosowanie wody w stanie pod- i nadkrytycznym
Synteza chemiczna
Wodę w stanie pod- i nadkrytycznym zastosowano w syntezie chemicznej jako medium reakcyjne m.in. w reakcji uwodornienia (np. dibenzotiofenu), odwodornienia (np. cykloheksanolu), tworzenia wiązań C-C (np. alkilowanie fenolu i p-krezolu za pomocą alkoholu tert-butylowego i 2-propanolu, reakcja Dielsa-Aldera), hydrolizie (np. estrów, nitryli, eterów, amidów, amin, niektórych polimerów), hydratacji (np. cykloheksenu do cykloheksanolu), dehydratacji (np. alkoholi do olefin), eliminacji (np. dekarboksylacja kwasów karboksylowych i dehydrohalogenowanie poli(chlorku winylu) i chlorku metylenu), przegrupowania (np. pinakolinowe, Beckmanna), częściowego utleniania (np. metanu, związków alkiloaromatycznych: p-ksylenu, toluenu), a także w reakcjach wolnorodnikowych i syntezie stereoselektywnej. Niektóre reakcje przedstawiono na rys. 3.
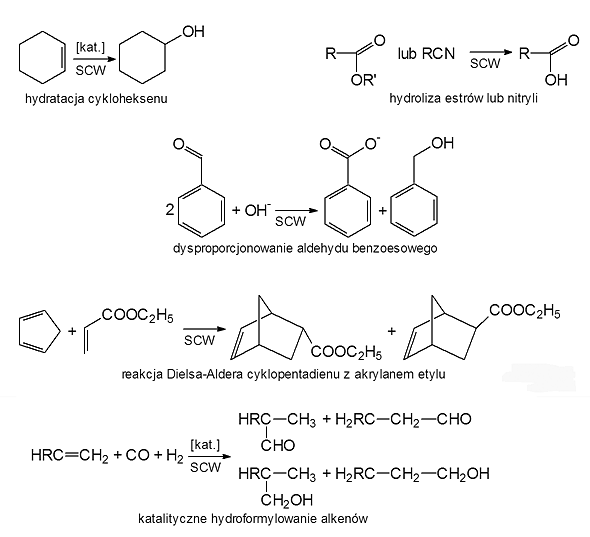
Rys. 3: Zastosowanie wody w stanie pod- i nadkrytycznym w syntezie chemicznej
Przykładem ilustrującym kierunki zastosowania SCW jest synteza kwasu tereftalowego (TPA), substratu wykorzystywanego do syntezy poli(tereftalanu etylenu) PET. Tradycyjny proces otrzymywania kwasu tereftalowego polega na katalitycznym (katalizator CoBr2) utlenianiu p-ksylenu powietrzem, w temperaturze 200 oC, pod ciśnieniem 1,5-3,0 MPa. Reakcja przebiega w obecności 95 % kwasu octowego. Produkt otrzymany tą metodą nie jest odpowiedni do syntezy PET, ponieważ zawiera barwne zanieczyszczenia, dlatego konieczne jest poddanie go dodatkowym energochłonnym operacjom, m.in. rozpuszczeniu w gorącej wodzie, katalitycznym uwodornieniu i krystalizacji. Istnieje możliwość zastąpienia kwasu octowego wodą w stanie pod- lub nadkrytycznym. Nowa metoda polega na katalitycznym (MnBr2) utlenieniu p-ksylenu w środowisku HCW, w temp. 200–400 oC, pod ciśnieniem 24–28 MPa, za pomocą tlenu powstającego na skutek termicznej degradacji H2O2 (rys. 4). W tych warunkach nie powstają produkty uboczne. Syntezę TPA w HCW charakteryzuje mniejsze zużycie energii, wynikające ze zmniejszenia liczby etapów pośrednich, a selektywność reakcji jest porównywalna z rozwiązaniem konwencjonalnym.
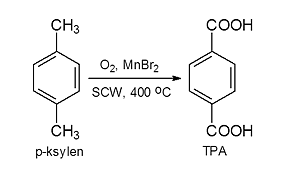
Rys. 4. Synteza kwasu tereftalowego w reakcji utleniania p-ksylenu w obecności SCW
Kolejnym przykładem zastosowania gorącej sprężonej wody jako medium reakcyjnego w syntezie chemicznej jest synteza p-izopropenylofenolu, który jest cennym reagentem wykorzystywanym do produkcji m.in. tworzyw wielkocząsteczkowych i pestycydów. Tradycyjnie otrzymywany jest on obok fenolu w reakcji rozkładu bisfenolu A w temp. powyżej 150 oC, w obecności zasady jako katalizatora. Powstały p-izopropenylofenol ulega w oligomeryzacji, co znacznie utrudnia jego wyodrębnienie z mieszaniny reakcyjnej i obniża wydajność procesu. Wg najnowszych koncepcji reakcję rozkładu bisfenolu A można przeprowadzić w wodzie w stanie podkrytycznym (200-350 oC) wykorzystując jej kwasowo-zasadowe właściwości katalityczne (rys. 5). Do zalet tej metody należy zaliczyć brak konieczności stosowania katalizatora zasadowego oraz łatwość wyodrębniania p-izopropenylofenolu z mieszaniny reakcyjnej (nie następuje reakcja oligomeryzacji).
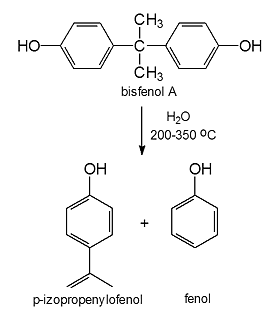
Rys. 5. Synteza p-izopropenylofenolu w wodzie w stanie podkrytycznym
Ilustracją właściwości rozpuszczalnikowych i katalitycznych SCW może być także jej wykorzystanie w reakcji prowadzącej do otrzymania e-kaprolaktamu, półproduktu do otrzymywania poliamidu 6
(PA 6). Wg tradycyjnej metody e-kaprolaktam jest syntezowany z benzenu, w procesach uwodornienia i utlenienia przetwarzany jest do cykloheksanonu, przekształcanego dalej do odpowiedniego
oksymu w reakcji z siarczanem hydroksyloaminy w obecności tritlenku siarki. Kolejnym etapem syntezy jest przegrupowanie oksymu do e-kaprolaktamu (przegrupowanie Beckmanna) (rys. 6),
zazwyczaj w środowisku 25 % oleum.
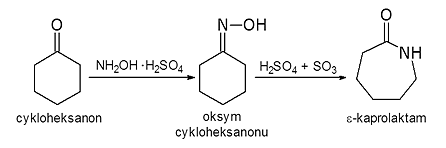
Rys. 6. Tradycyjna metoda syntezy e-kaprolaktamu
Produkt reakcji poddaje się zobojętnieniu amoniakiem, oczyszczeniu przez ekstrakcję trichloroetylenem, a potem wodą, a następnie zatężeniu w wyparkach i krystalizacji. Proces m.in. ze względu na stosowanie niebezpiecznych rozpuszczalników (oleum, trichloroetylen) i z powodu powstawania dużych ilości odpadowego siarczanu amonu (4,5 kg na 1 kg e-kaprolaktamu), jest uciążliwy dla środowiska. Dlatego podjęto badania mające na celu zastosowanie SCW (375 oC, 40 MPa) jako rozpuszczalnika i kwasowego katalizatora w reakcji przegrupowania Beckmanna oksymu cykloheksanonu. Wg nowej propozycji, eliminującej konieczność użycia oleum i upraszczającej proces wyodrębnienia produktu z mieszaniny reakcyjnej, e-kaprolaktam otrzymywany jest z 99 % selektywnością i wydajnością sięgającą 99,5 %.
Zagospodarowanie związków odpadowych do produktów użytecznych
Woda w stanie pod- i nadkrytycznym może być wykorzystana także jako medium reakcyjne (rozpuszczalnik i reagent) w procesach kontrolowanej destrukcji niektórych odpadowych substancji organicznych do produktów użytecznych na drodze ich hydrolizy.
Do grupy produktów, które można poddać zagospodarowaniu w procesie hydrolizy w wodzie w stanie podkrytycznym należą np. odpady z rybołóstwa i przemysłu rybnego. Odpady te bogate m.in. w tłuszcze i proteiny o dużej wartości odżywczej, zwykle poddawane są spalaniu, powodującemu nieodwracalną utratę tych cennych składników. Ponadto niepożądanym produktem spalania mogą być niebezpieczne dla środowiska lotne popioły i dioksyny. Natomiast podczas hydrolizy przebiegającej w wodzie w stanie podkrytycznym o odpowiednio dobranej temperaturze i ciśnieniu, następuje kontrolowany rozkład, nie prowadzący do pełnej mineralizacji substancji organicznych zawartych w odpadach i umożliwiający ich odzyskanie.
W warunkach hydrotermalnych (w wodzie w stanie pod- lub nadkrytycznym) niektóre polimery (zużyte lub odpadowe), zawierające w łańcuchu głównym wiązania estrowe, eterowe, amidowe, uretanowe lub mocznikowe, można poddać procesowi depolimeryzacji hydrolitycznej, mającemu na celu odzyskanie monomerów- substancji wyjściowych do ponownej produkcji polimerów. Taką odmianę recyklingu surowcowego zastosowano do rozkładu m.in. PET, poli(węglanu bisfenolu A) i poliamidów. Hydrolizę PET, prowadzącą do otrzymania TPA i glikolu etylenowego (EG) przeprowadzono zarówno w wodzie w stanie podkrytycznym, jak i w SCW. W SCW w czasie reakcji trwającej 12,5 min. uzyskano TPA z wydajnością bliską 100 % (rys. 7).
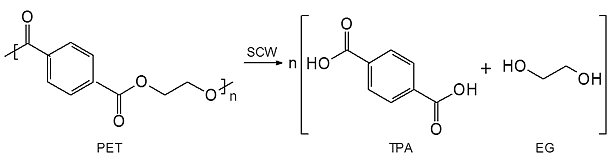
Rys. 7: Depolimeryzacja hydrolityczna PET w wodzie w stanie nadkrytycznym
Celem hydrotermalnej depolimeryzacji poli(węglanu bisfenolu A) (PC) było otrzymanie bisfenolu A (rys. 8).
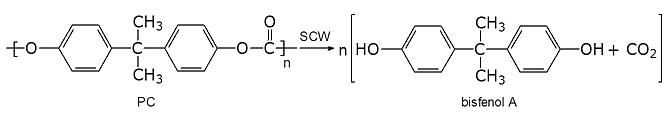
Rys. 8: Hydrotermalna depolimeryzacja poli(węglanu bisfenolu A)
Pełna dekompozycja PC, bez powstawania niepożądanych produktów ubocznych, następowała w temperaturze 400 oC, pod ciśnieniem 25 MPa, w czasie kilku minut. W wyższych temperaturach obserwowano szybko następujący rozkład bisfenolu A i wówczas głównym produktem reakcji był fenol. Badania nad recyklingiem poliamidów w warunkach hydrotermalnych, przeprowadzono m.in. dla poliamidu 6 (rys. 9).
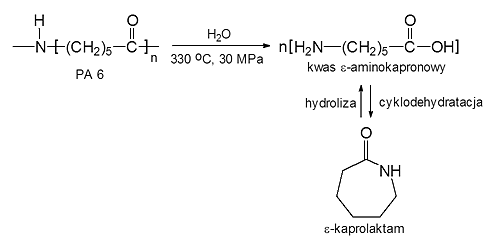
Rys. 9: Depolimeryzacja poliamidu 6 w warunkach hydrotermalnych
Poddając hydrolizie poliamid 6, spodziewano się, że będzie możliwy ilościowy odzysk kwasu ε-aminokapronowego lub ε-kaprolaktamu- produktu cyklodehydratacji kwasu ε-aminokapronowego. W wyniku depolimeryzacji, przebiegającej w wodzie w stanie nadkrytycznym, możliwe było efektywne otrzymanie i wyodrębnienie monomerów prawie ze 100 % wydajnością. Podjęto także udane próby hydrotermalnej depolimeryzacji poliuretanów a nawet recyklingu surowcowego duroplastów, takich jak żywice fenolowe, przeprowadzając dekompozycję prepolimerów i tłoczyw fenolowych. W przypadku prepolimerów produktami reakcji otrzymanymi z wydajnością ok. 90 % były: fenol, krezole i p-izopropylofenol. Natomiast produktami rozkładu uformowanych żywic były fenol i krezole. Również żywice epoksydowe poddano katalitycznemu (Na2CO3) rozkładowi w wodzie w stanie pod- i nadkrytycznym, prowadzącemu do fenolu i alkilofenoli.
Oczyszczanie ścieków i utylizacja odpadów
Konieczność zapewnienia bezpiecznej neutralizacji niebezpiecznych i trudno ulegających degradacji biologicznej odpadów oraz ścieków przemysłowych i komunalnych staje się coraz poważniejszym problemem, a tradycyjne rozwiązania nie zapewniają skutecznej eliminacji wszystkich zanieczyszczeń. Często stosowaną, efektywną metodą destrukcji ścieków i odpadów organicznych jest ich spalanie, które prowadzi do redukcji objętości zanieczyszczeń, ale jest procesem koszto- i energochłonnym. Ponadto wadą tego rozwiązania jest możliwość powstawania w trakcie trwania procesu zanieczyszczeń gazowych, takich jak tlenki siarki, azotu czy dioksyny, które wymagają usuwania ze strumienia spalin. Dlatego w ostatnich latach duże zainteresowanie budzi możliwość neutralizacji niebezpiecznych odpadów i ścieków w procesie ich hydrotermalnego utleniania SCWO (supercritical water oxidation). SCWO jest procesem całkowitego utleniania związków organicznych tlenem, w obecności wody w stanie nadkrytycznym, w temp. 400-700 oC, pod ciśnieniem ok. 25 MPa (np. reakcje 1-3).
benzen
C6H6 + 7,5O2 → 6CO2 + 3H2O (1)
trichlorometan (chloroform)
CHCl3 + 0,5O2 + H2O → CO2 + 3HCl (2)
2,4,6-trinitrotoluen (trotyl)
CH3-C6H2-(NO2)3 + 5,25O2 → 7CO2 + 2,5H2O + 1,5N2
(3)
Węgiel zawarty w substancjach organicznych utleniany jest do ditlenku węgla, wodór do wody, azot związany do wolnego lub tlenku azotu, a z pozostałych heteroatomów (np. fluorowce, siarka) otrzymywane są odpowiednie kwasy lub sole. Metale ciężkie po utlenieniu tworzą z innymi stałymi pozostałościami popiół, o właściwościach odpowiednich do wykorzystania w budownictwie. Do korzyści wynikających z zastosowania warunków hydrotermalnych należą homogeniczność układu reakcyjnego, duża szybkość reakcji (rzędu sekund lub minut), brak ograniczeń transportu materiałowego, dobre właściwości rozpuszczalnikowe SCW w stosunku do substancji organicznych i tlenu jako utleniacza, możliwość zapewnienia pełnego przebiegu reakcji utleniania (stopień destrukcji przekracza 99 %) oraz brak negatywnego wpływu na środowisko. Trwają intensywne prace badawcze, prowadzone zarówno w skali laboratoryjnej, jak i pilotowej, nad optymalizacją przebiegu procesu SCWO, który zastosowano zarówno do utlenienia prostych substancji modelowych (metanolu, kwasu octowego, fenolu, nitrobenzenu, chlorku metylenu) (tabela 4), jak i skomplikowanych mieszanin, takich jak osady pochodzące ze ścieków komunalnych, odpady radioaktywne, chemiczne środki bojowe, wielopierścieniowe węglowodory aromatyczne, dioksyny, polichlorowane bifenyle PCBs (polychlorinated biphenyls), a także odchody zwierząt hodowlanych. W procesie ich głębokiego utleniającego rozkładu, najlepsze rezultaty uzyskano prowadząc proces w temp. 650 oC, pod ciśnieniem 15 MPa, w czasie 15 min., przy 20 % nadmiarze tlenu w stosunku do zapotrzebowania stechiometrycznego. Energia cieplna jaką odzyskano wyniosła 2,87 x 106 kJ/tonę surowych odchodów, co odpowiada 70 litrom ciężkiego oleju opałowego.
Tabela 4: Wybrane substancje modelowe poddane SCWO
|
związek |
temperatura [oC] |
czas [min] |
wydajność [%] |
|
cykloheksan |
445 |
7,0 |
99,97 |
|
o-ksylen |
495 |
3,6 |
99,93 |
|
1,1,1-trichloroetan |
495 |
3,6 |
99,99 |
|
1,1,2,2-tetrachloroetylen |
495 | 3,6 | 99,99 |
|
o-chlorotoluen |
495 | 3,6 | 99,99 |
|
1,2,4-trichlorobenzen |
495 |
3,6 |
99,99 |
|
4,4-dichlorobifenyl |
500 |
4,4 |
99,993 |
|
DDT1 |
505 |
3,7 |
99,997 |
|
PCB 1234 |
510 |
3,7 |
99,99 |
|
keton metylowo-etylowy |
505 |
3,7 |
99,993 |
|
2,4-dinitrotoluen |
574 |
0,5 |
99,9998 |
1 - 1,1,1-trichloro-2,2-bis(p-chlorofenyl)etan
W wielu ośrodkach badawczych opracowano koncepcję procesu SCWO, m.in. w Sandia National Laboratories (USA), Turbosystems Engineering Inc. (USA), General Atomics (USA) i szwedzkiej firmie Chematur Engineering AB, która uruchomiła instalację pilotową rozkładu ścieków komunalnych (technologia Aqua Critox), odpowiednią także dla efektywnego usuwania zanieczyszczeń z wielu gałęzi przemysłu, m.in. papierniczego i farmaceutycznego (Aqua Reci). Ścieki pobierane są ze zbiornika magazynowego, ulegają podgrzaniu w wymienniku ciepła do temp. ok. 400 oC i tłoczone są pompami wysokiego ciśnienia (ok. 25 MPa) do reaktora, w którym w obecności doprowadzonego tlenu zachodzi reakcja utleniania. Ciepło tej egzotermicznej reakcji odzyskuje się w dalszej części instalacji. Woda po schłodzeniu w chłodnicy i rozprężeniu w zaworze redukcyjnym wpływa do separatora gazów i cieczy, w którym następuje oddzielenie gazów (głównie CO2, N2, O2) od wody.
Przetwarzanie biomasy
Kolejnym obszarem zastosowania wody w stanie pod- i nadkrytycznym jest jej wykorzystanie w roli medium reakcyjnego do procesów przetwarzania biomasy (odpady rolnicze, leśne, ogrodnicze, pozostałości z przemysłu rolno-spożywczego i drzewnego, osady ściekowe), a w szczególności jej zgazowania, prowadzącego do otrzymania frakcji palnych produktów gazowych o średniej wartości energetycznej, bogatej w wodór, metan lub ich mieszaninę. Uzyskany gaz można poddać następnie reformowaniu zapewniającemu wzrost zawartości wodoru, lub metanizacji, wzbogacającej produkt w metan, będący substytutem naturalnego gazu ziemnego SNG (synthetic natural gas). Biomasa jest tanim, odnawialnym i powszechnie dostępnym źródłem energii a zgodnie z prognozami, w kolejnych latach biopaliwa z niej pozyskiwane będą w coraz większym stopniu zastępować produkty tradycyjne. Zgazowanie jest jednym z termochemicznych procesów przeksztłacania biomasy, prowadzącym do otrzymywania biopaliw. Tradycyjne zgazowanie biomasy przebiega w temp. powyżej 600 oC, w obecności powietrza, tlenu lub pary wodnej. Ponieważ wilgotna biomasa ma niską wartość opałową, jej przerabianie wymaga koszto- i energochłonnej obróbki wstępnej, a w szczególności suszenia do zawartości wilgoci nie przekraczającej 10-15 %. W trakcie trwania procesu, w zależności od zastosowanych parametrów, zachodzą m.in. reakcje częściowego (4) i całkowitego utleniania węgla zawartego w biomasie (5), reakcja wytwarzania gazu wodnego (6), reakcja konwersji tlenku węgla parą wodną WGS (water gas shift) (7) i reakcja metanizacji (8).
C + 0,5O2 → CO (4)
C + O2 → CO2 (5)
C + H2O → CO + H2 (6)
CO + H2O → CO2 + H2 (7)
CO + 3H2 → CH4 + H2O (8)
W wyniku zgazowania biomasy otrzymywany jest gaz, będący mieszaniną wodoru, tlenku węgla, ditlenku węgla, metanu i lekkich węglowodorów. Powstają także znaczne ilości karbonizatu (stała, zwęglona pozostałość) i smoły, a produktem ubocznym jest popiół i w wyższych temperaturach zgazowania zużel. Produkt gazowy poddawany jest zwykle dodatkowo procesowi reformingu parowego, w wyniku którego otrzymywany jest gaz syntezowy (CO + H2), wykorzystywany do produkcji wodoru i innych paliw oraz chemikaliów (m.in. metanol, amoniak). Szczególnie wartościowym produktem otrzymywanym w wyniku zgazowania biomasy jest wodór, który może stać się w przyszłości ważnym, czystym nośnikiem energii.
Nowym sposobem energetycznego wykorzystania zawodnionej, odpadowej biomasy (m.in. odchodów zwierząt hodowlanych, słomy, trocin, kiszonki kukurydzy i koniczyny) zawierającej nawet do 95 % wag. wody, jest jej jednoetapowe przekształcenie w procesie hydrotermalnego zgazowania SCWG, przebiegającego w wodzie w stanie pod- i nadkrytycznym, pełniącej rolę zarówno rozpuszczalnika składników biomasy, jak i reagenta (dodatkowe źródło wodoru). Proces SCWG może przebiegać bez udziału lub w obecności katalizatora jako proces niskotemperaturowy (300-550 oC) lub wysokotemperaturowy, zachodzący w temp. wyższej niż 550 oC. W czasie trwania procesu zachodzą zarówno reakcje hydrolizy, pirolizy, WGS, jak i reformingu oraz metanizacji. Obecność katalizatorów poprawia efektywność przebiegu procesu. Sole oraz wodorotlenki sodu i potasu katalizują przebieg reakcji WGS. W obecności węglanu potasu początkowo powstaje mrówczas potasu- reaktywny produkt pośredni (9, 10).
K2CO3 + H2O → KHCO3 + KOH (9)
KOH + CO → HCOOK (10)
W reakcji mrówczanu potasu z wodą (11) i w reakcji WGS (12) otrzymywany jest wodór.
HCOOK + H2O → KHCO3 + H2 (11)
H2O + CO ↔ HCOOH ↔ H2 + CO2 (12)
Ditlenek węgla jest produktem reakcji WGS (12) i rozkładu wodorowęglanu potasu (13).
2KHCO3 → H2O + K2CO3 + CO2 (13)
Z kolei wodorotlenek potasu może katalizować przebieg reakcji tworzenia kwasu mrówkowego, który jako nietrwały produkt pośredni reakcji WGS ulega degradacji do wodoru i ditlenku węgla (9). Obecność katalizatorów alkalicznych pozwala na otrzymanie większych ilości H2 i CO2 oraz obniżenie zawartości CO we frakcji produktów gazowych. Katalizatory uwodornienia, takie jak nikiel i ruten wpływają przede wszystkim na przebieg metanizacji, przyczyniając się do wzrostu zawartości metanu we frakcji produktów gazowych. W obecności katalizatora rutenowego przebieg zgazowania ilustrują reakcje (14-17).
RuO2 + biomasa → Ru2+ + biomasa+ + CO (14)
CO + 3H2 → CH3 + H2O (15)
2CO + 2H2 → CH4 + CO2 (16)
Ru2+ + 2H2O → RuO2 + 2H+ + H2 (17)
gdzie biomasa+ oznacza pośredni produkt zgazowania organicznych składników biomasy. Proces niskotemperaturowego hydrotermalnego zgazowania biomasy, a szczególnie jej stężonych roztworów, cechuje niska efektywność zgazowania, niezadowalająca wydajność wodoru i, podobnie jak w procesie tradycyjnym, obecność w produktach procesu frakcji karbonizatu oraz substancji smolistych. Poprawa efektywności hydrotermalnego zgazowania biomasy jest możliwa w wyniku jej przetworzenia wysokotemperaturowego, ponieważ w wyższych temperaturach proces przebiega wg mechanizmu wolnorodnikowego, sprzyjającego otrzymaniu większej ilości produktów gazowych i zapobiegającego wydzieleniu się produktów niepożądanych (rys. 10).
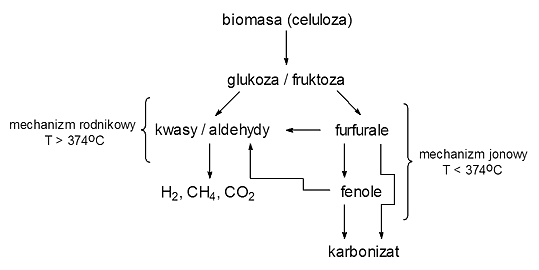
Rys. 10. Najważniejsze substancje powstające podczas zgazowania celulozy w SCW
Ze wzrostem temperatury następuje także wzrost zawartości wodoru we frakcji produktów gazowych. W procesie SCWG otrzymywany jest wodór o wysokiej czystości i pod wysokim ciśnieniem, co jest użyteczne ze względu na jego dalsze zastosowanie. Pomyślne rezultaty badań nad hydrotermalnym zgazowaniem w skali laboratoryjnej umożliwiły uruchomienie w ostatnich latach instalacji pilotowych w Niemczech i Holandii, w których trwają prace badawcze nad optymalizacją przebiegu procesu i możliwością jego zastosowania do efektywnego zagospodarowania odpadowej biomasy. W 2002 r. w Centrum Badawczym w Karlsruhe uruchomiono instalację pilotową VERENA (Versuchsanlage zur energetischen Nutzung agrarwirtschaftlicher Stoffe), o przepustowości 100 kg/godz. surowca, pracującą w systemie ciągłym. Z kolei w Holandii firma Biomass Technology Group we współpracy z Uniwersytetem w Twente zbudowała i uruchomiła w Enschede instalację pilotową PDU (process development unit) wysokotemperaturowego hydrotermalnego zgazowania, pracującą w systemie ciągłym, zasilaną 3 – 30 kg/godz. biomasy. Parametry pracy reaktora wynoszą 600-650oC, ciśnienie do 30 MPa, czas przebywania surowców w reaktorze 10-120 s. Sekcja rozdziału produktów zawartych w surowym gazie składa się z separatora wysokociśnieniowego HP (high-pressure) (temp. 25-100oC, ciśnienie 30 MPa) i niskociśnieniowego LP (low-pressure) (temp. 20 oC, ciśnienie 0,1 MPa). W separatorze HP uzykiwany jest gaz wzbogacony w H2 (ok. 63 % obj.), a w separatorze LP otrzymany gaz zawiera głównie CO2 (72 % obj.) i niewielkie ilości H2 (ok. 16 % obj.).
W obecności wody w stanie pod- i nadkrytycznym reakcje syntezy chemicznej, hydrolitycznego i utleniającego rozkładu substancji organicznych oraz przerobu biomasy przebiegają efektywnie, z wysokim stopniem konwersji i selektywnością. Ze względu na wciąż wysokie koszty budowy i funkcjonowania instalacji wykorzystujących gorącą sprężoną wodę, szczególnego znaczenia nabiera problem bilansu energetycznego takich procesów. Jednym z problemów ograniczających zastosowanie wody w stanie pod- i nadkrytycznym jest jej wysoka korozyjność w pobliżu punktu krytycznego. Wprawdzie istnieje możliwość wykorzystania do budowy reaktorów materiałów konstrukcyjnych odpornych na działanie SCW (tytan i jego stopy, zawierające m.in. Mo, Nb, Ta, Pt, Rh, Ir), ale ich cena jest bardzo wysoka. Kolejnym problemem jest zła rozpuszczalność soli nieorganicznych w SCW. Ich wytrącanie może powodować zapychanie się przewodów reaktora i zmieniać niekorzystnie parametry przepływu strumienia surowca. Ponadto, niektóre związki organiczne obecne w roztworze zasilającym reaktor łatwo ulegają polimeryzacji z utworzeniem nierozpuszczalnych w warunkach reakcji produktów smolistych lub karbonizatu, osadzających się na powierzchni reaktora lub w jego przewodach przepływowych.
Uzyskane wyniki badań jednoznacznie wskazują na możliwość efektywnego i bezpiecznego dla środowiska zastosowania wody w stanie pod- lub nadkrytycznym jako rozpuszczalnika, katalizatora lub reagenta w wielu reakcjach syntezy chemicznej i procesach rozkładu niebezpiecznych substancji organicznych. Należy przy tym dodać, że dotyczą one głównie prac prowadzonych w skali laboratoryjnej lub pilotowej, a o komercjalizacji tych metod jeszcze będą przesądzać aspekty techniczne, technologiczne i ekonomiczne. Jednakże wyniki uzyskiwane w instalacjach pilotowych pozwalają przypuszczać, że będzie następować dalszy rozwój technologii wykorzystujących wodę w stanie pod- i nadkrytycznym, prowadzący do rozszerzenia praktycznych zastosowań procesów przebiegających w warunkach hydrotermalnych.
